Infrastruktureinrichtungen und Anlagen im Leibniz-Institut für Pflanzengenetik und Kulturpflanzenforschung in Gatersleben, IPK

Für weitere Informationen kontaktieren Sie bitte die folgenden Personen:
Thomas Altmann, Prof. Dr. altmann@ipk-gatersleben.de oder
Astrid Junker, Dr. junkera@ipk-gatersleben.de
Die verschiedenen Infrastruktureinrichtungen werden in folgende Gruppen unterteilt:
Technologieplattform Shoot
Systeme zur automatisierten Phänotypisierung im Hochdurchsatz
von kleinen Pflanzen |
von mittelgroßen Pflanzen | |
|---|---|---|
 |  | |
| nähere Infos | nähere Infos | |
| Standort der Anlage | klimatisierte Phytokammer | Gewächshaus |
| Untersuchungsobjekt | vollständige Pflanzen | vollständige Pflanzen |
| Kapazität | 384 – 4608 Pflanzen | 520 Pflanzen |
| Pflanzengröße/Art | Maximale Pflanzenbreite: 3 – 9.5cm Maximale Pflanzenhöhe: 30cm z.B. Arabidopsis, Brachypodium | Maximale Pflanzenbreite: 30 cm Maximale Pflanzenhöhe: 140 cm z.B. Hordeum vulgare |
| Methode | Fluoreszenz-Imaging (Anregung : 400 bis 500 nm, Emission : 520 bis 750 nm) , Imaging im sichtbaren Licht (390-750 nm) und Imaging im Nahinfrarot -Bereich ( 1450-1550 nm) | Fluoreszenz-Imaging (Anregung : 400 bis 500 nm, Emission : 520 bis 750 nm) , Imaging im sichtbaren Licht (390-750 nm) und Imaging im Nahinfrarot -Bereich ( 1450-1550 nm) |
| Messbare Eigenschaften/Parameter | Architektonische Pflanzenmerkmale (Pflanzenhöhe und-breite, projizierte Blattfläche aus Aufsicht und Seitenansicht), geschätzte Pflanzenbiomasse Farbparameter Pixelverteilung in verschiedenen Farbklassen, Farbintensität, -sättigung Physiologische Merkmale Chlorophyllfluoreszenz, Parameter mit Bezug zum Feuchtigkeitsgehalt der Pflanze | Architektonische Pflanzenmerkmale (Pflanzenhöhe und-breite, projizierte Blattfläche aus Aufsicht und Seitenansicht), geschätzte Pflanzenbiomasse Farbparameter Pixelverteilung in verschiedenen Farbklassen, Farbintensität, -sättigung Physiologische Merkmale Chlorophyllfluoreszenz, Parameter mit Bezug zum Feuchtigkeitsgehalt der Pflanze |
von großen Pflanzen |
Phenobot (in der Entwicklung) | |
|---|---|---|
 |  | |
| nähere Infos | nähere Infos | |
| Standort der Anlage | Gewächshaus | Gewächshaus, stationär (Versetzen möglich) |
| Untersuchungsobjekt | vollständige Pflanzen | Blattoberflächen (Trichome), automatische Auswahl repräsentativer Blattbereiche |
| Kapazität | 396 - 1584 Pflanzen | etwa 90 Pflanzen pro Tag |
| Pflanzengröße/Art | Maximale Pflanzenbreite: 70 cm Maximale Pflanzenhöhe: 230 cm z.B. Zea mays | Pflanzenrosetten, krautige Pflanzen ,Gräser (z.B. Arabidopsis, Tabak, Gerste) |
| Methode | Fluoreszenz-Imaging (Anregung: 400-500 nm, Emission: 520-750 nm), Imaging im sichtbaren Licht (390-750 nm) und Imaging im Nahinfrarot-Bereich (1450-1550 nm) | Bildgebende Verfahren, Time-of-Flight-Sensor für die 3D Rekonstruktion und hochauflösende RGB Kamera |
| Messbare Eigenschaften/Parameter | Architektonische Pflanzenmerkmale (Pflanzenhöhe und-breite, projizierte Blattfläche aus Aufsicht und Seitenansicht), geschätzte Pflanzenbiomasse Farbparameter Pixelverteilung in verschiedenen Farbklassen, Farbintensität, -sättigung Physiologische Merkmale Chlorophyllfluoreszenz, Parameter mit Bezug zum Feuchtigkeitsgehalt der Pflanze | Trichome pro Fläche, Trichomtypen (in der Testphase) |
Technologieplattform Patho
Plattformen zur mikroskopischen und makroskopischen Analyse von Pflanze-Pathogen Interaktionen im Hochdurchsatz
Die exakte Beschreibung der Anfangsstadien der Infektion einer Pflanze (Pflanzenzelle) durch ein mikrobielles Pathogen erfordert mikroskopische Techniken. Die entwickelte ‚Microphenomics‘ – Plattform kombiniert die Vorteile dieser Techniken mit den Anforderungen für ein hochdurchsatztaugliches phänotypisches Screening-Verfahren welches die Hochdurchsatz- DNA – Klonierung und -Transformation einzelner Pflanzenzellen und automatisierte Mikroskopie- und Bildanalyseabläufe ermöglicht. Die Plattform wurde erfolgreich eingesetzt um die Funktion von Genen bei der nichtwirts- und rassenunspezifischen Wirtsresistenz von Gerste gegenüber dem Mehltaupilz Blumeria graminis zu untersuchen.
Weitere Phänotypisierungsmethoden befinden sich in der Entwicklung, welche den kompletten asexuellen Interaktionszyklus von Mehltau und Gerste abdecken und außerdem eine quantitative Einschätzung der Krankheitssymptome und Wirtsreaktionen erlauben sollen.
Das Gerste/ Mehltau (Blumeria graminis f.sp. hordei)- und das Weizen / Mehltau (Blumeria graminis f-sp. tritici) - System sind gegenwärtig die am weitesten entwickelten Pathosysteme. Weitere Pathosysteme sind verfügbar: Gerste/Blattfleckenkrankheit (Bipolaris sorokiniana) und Arabidopsis thaliana/Mehltau (Golovinomyces orontii).

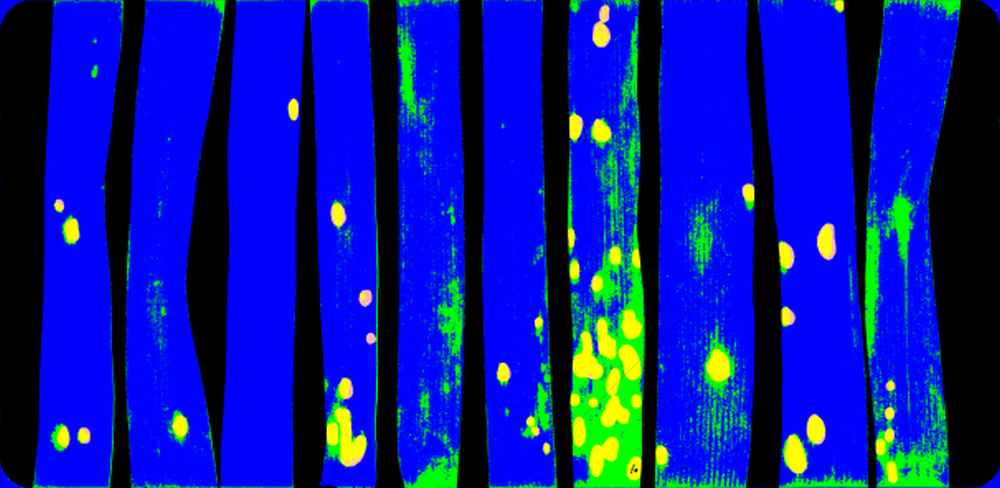
Microphenomics facility |
Macrophenomics facility | |
|---|---|---|
 |  | |
| nähere Infos | nähere Infos | |
| Standort der Anlage | IPK, Labor im Genomzentrum | IPK, Labor im Genomzentrum |
| Untersuchungsobjekt | abgetrennte Blätter | abgetrennte Blätter |
| Kapazität | bis zu 80 RNAi-Zielgene pro Woche; bis zu 300 Genotypen pro Woche | Bis zu 500 Genotypen in 3-4 Wochen |
| Pflanzengröße/Art | Pflanzen: H. vulgare, T. aestivum, A. thalianaPathogene: B. graminis, G. orontii | Planzen: H. vulgare, T. aestivum, A. thalianaPathogene: B. graminis, B. sorokiniana, G. orontii |
| Methode | Bildgebende Mikroskopie | Multispektral- Imaging (365-850 nm) |
| Untersuchte Parameter | Effizienz der pilzlichen Penetration; Wachstum der Pilzhyphen | Anzahl der Pilzkolonien pro Blattfläche; Fläche der Kolonien; Pflanzliche Reaktionen (Melanisierung, Epifluoreszenz) |
Technologieplattform Field
AgRover | |
|---|---|
 | |
| nähere Infos | |
| Anwendungsbereich | Felder oder Flurstücke (einfach zu transportieren) |
| Untersuchungsobjekte | Flurstücke/ganze Pflanzen |
| Kapazität | ~ 3 km/Tag (ca. ~ 600 x 5 m Flächen) |
| Pflanzengröße | Pflanzen bis zu einer maximalen Größe von 60-80 cm |
| Methode | Hyperspektrales bildgebendes Verfahren (1000 - 2500µm), Auf- und Seitenansicht |
| Parameter | Physiologischer Status (z.B. Nährstoffgehalt) Wurzeltiefe (indirekt) |
